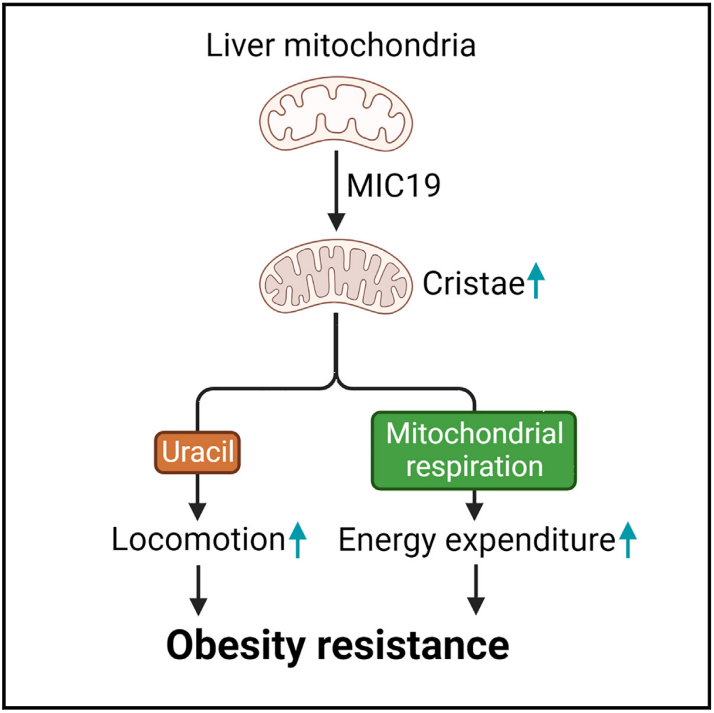
营养过剩和低运动量能引起多种代谢疾病,例如:肥胖症和2型糖尿病等。目前,应对营养过剩、肥胖症和2型糖尿病临床并发症的策略包括个性化的饮食方案和体育锻炼相结合。然而,由于肥胖等原因导致脂质在非脂肪组织(肝脏)的累积诱发非酒精性脂肪肝,进而发展为非酒精性脂肪肝炎、肝纤维化和肝癌【1-3】。肝脏作为主要的代谢器官,能有效地在不同组织间分配代谢物,控制全身的能量和代谢物稳态。有研究发现在禁食期间,肝脏会促进线粒体的活力,以支持葡萄糖的产生和酮体的生成,维持血糖水平并为大脑提供酮体【4-6】。但是,在这些条件下驱动线粒体生物能和动力学的机制仍不清楚。近期,来自美国Dana-Farber 癌症研究所的Pere Puigserver研究组在Cell Metabolism上发表了文章Liver mitochondrial cristae organizing protein MIC19 promotes energy expenditure and pedestrian locomotion by altering nucleotide metabolism,该研究发现线粒体嵴组织蛋白MIC19能促进嵴的形成,通过重塑肝脏能量代谢并增加小鼠的运动来提高能量消耗,阐明了嵴形成的营养依赖性调控机制,以及嵴是如何影响肝脏和全身的能量代谢。与广泛使用的C57BL/6小鼠不同,CD-1小鼠对于高脂饮食导致的肝脏脂肪变性有较强的抵抗能力【7】。而肝脏代谢疾病与线粒体功能紊乱密切相关,研究人员认为利用CD-1和C57BL/6小鼠可以研究肝脏线粒体在不同饮食条件下的代谢功能。首先,研究人员比较分析了自由采食和禁食条件下两种品系小鼠的肝脏线粒体蛋白质组,CD-1小鼠在禁食时有145个线粒体蛋白水平上调,而C57BL/6小鼠仅有16个线粒体蛋白水平上调。GO注释发现CD-1小鼠中上调的145个蛋白与线粒体内膜结构和功能相关,包括了呼吸链复合物和嵴结构相关蛋白。其中线粒体接触部位和嵴组织系统(mitochondrial contact site and cristae-organizing system, MICOS)复合物的的多个亚基水平上升,尤其是MIC19的上调最为显著。这些结果暗示着禁食能引起CD-1小鼠肝脏线粒体的嵴结构和功能重塑。因此,研究人员接着通过透射电镜和呼吸链功能分析,发现在禁食能诱导CD-1小鼠的肝脏线粒体中形成更多的嵴,并且呼吸链复合物的功能得到增强,而C57BL/6小鼠中并不能观察到这些现象。有趣的是,在C57BL/6小鼠肝脏中过表达MIC19能增加线粒体内膜嵴的含量,重塑肝脏代谢程序,抑制葡萄糖生成,促进脂肪酸氧化,这与禁食处理的结果类似。基于上述结果,研究人员推测MIC19的过表达可能有益于肥胖症/2型糖尿病/脂肪肝等疾病,因为这些疾病导致肝脏积累过量的脂肪以及无节制的产生葡萄糖。为了验证这一猜想,该课题组进而用高脂饮食饲养在肝脏中过表达MIC19的小鼠,与对照相比MIC19的过表达抑制了高脂饮食引起的体重和脂肪含量增加,同时下调了甘油三酯和血糖水平,增加了琥珀酸驱动的线粒体呼吸水平,这些结果表明MIC19对肝脏和全身能量代谢都大有脾益。为了研究MIC19是如何发挥上述功能的,研究人员利用Promethion Mouse Multiplexed Metabolic System系统地研究了小鼠的代谢参数,包括运动、能量消耗和呼吸交换率。研究发现肝脏中过表达MIC19小鼠的运动和能量消耗水平都显著增加,能量消耗的增加不仅是由于运动水平的增加,同时也与肝脏能量代谢的改变有关。进一步的利用代谢组学,研究人员发现MIC19在肝脏中过表达导致尿嘧啶的含量增加,而在食物中额外补充尿嘧啶能提高小鼠的运动水平,增强对高脂饮食引起的体重增加的抵抗能力,但不能改变能量的消耗水平。最后,研究人员发现肝脏中过表达MIC19增强了肝脏的一碳代谢(one-carbon metabolism)活力进而增加了谷胱甘肽(gluthathione, GSH)的含量,而GSH调控了氧化还原敏感酶UPP2的活性,UPP2将肝脏中的尿苷转换为尿嘧啶,由此提高了小鼠的运动水平。综上所述,这篇文章揭示了肝脏线粒体能量代谢在抵抗肥胖症中的潜在作用,具体来说是通过MIC19促进线粒体嵴的形成,采用双管齐下的方式【(1)增加尿嘧啶在肝脏中的积累促进小鼠的运动水平;(2)提高线粒体呼吸能力增加能量消耗水平】应对营养过剩导致的代谢疾病。https://www.cell.com/cell-metabolism/pdfExtended/S1550-4131(23)00225-5
1. Bence KK, Birnbaum MJ. Metabolic drivers of non-alcoholic fatty liver disease. Mol Metab. 2021;50:101143.
2. Chalasani N, Younossi Z, Lavine JE, et al. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American Association for the Study of Liver Diseases. Hepatology. 2018;67(1):328-357.
3. Sheka AC, Adeyi O, Thompson J, Hameed B, Crawford PA, Ikramuddin S. Nonalcoholic Steatohepatitis: A Review [published correction appears in JAMA. 2020 Apr 28;323(16):1619]. JAMA. 2020;323(12):1175-1183.
4. Fernandes GW, Bocco BMLC. Hepatic Mediators of Lipid Metabolism and Ketogenesis: Focus on Fatty Liver and Diabetes. Curr Diabetes Rev. 2021;17(7):e110320187539.
5. Perry RJ, Zhang D, Guerra MT, et al. Glucagon stimulates gluconeogenesis by INSP3R1-mediated hepatic lipolysis. Nature. 2020;579(7798):279-283.
6. Rines AK, Sharabi K, Tavares CD, Puigserver P. Targeting hepatic glucose metabolism in the treatment of type 2 diabetes. Nat Rev Drug Discov. 2016;15(11):786-804.
7. Fengler VH, Macheiner T, Kessler SM, et al. Susceptibility of Different Mouse Wild Type Strains to Develop Diet-Induced NAFLD/AFLD-Associated Liver Disease. PLoS One. 2016;11(5):e0155163.